| 氧气的性质和用途之一 |
| 作者:浙江省杭州市学军中学 陈士良 |
|
教学目标 1.认识氧气的物理、化学性质,了解氧气的用途。 2.掌握化合反应的概念,初步了解氧化反应。 3.通过氧气性质的课堂实验,培养学生观察能力和分析综合能力,使他们初步懂得用实验手段来研究物质性质的科学方法。 教学过程 展示三瓶未知气体,观察颜色、嗅气味并记录。(未知气体是氮气、二氧化碳和氧气。记录表在课前准备。)
这三种未知气体各是什么?请看实验,并记录现象。 【教师演示】
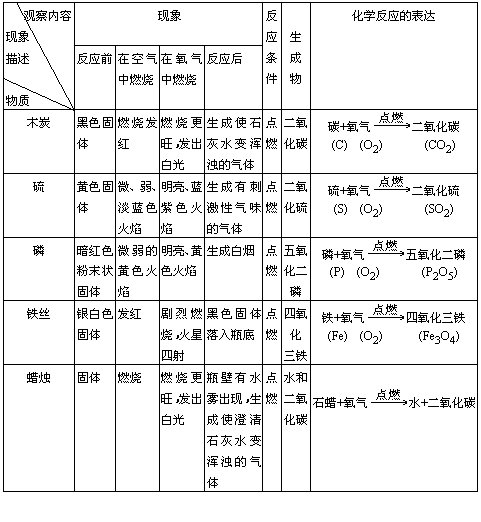
【讲述】 能使有余烬木条重新燃烧的是氧气(O2),能使澄清石灰水变浑浊的气体是二氧化碳(CO2),另一瓶不能用简单方法检出的气体是氮气(N2)。 【引言】氧气、氮气、二氧化碳气体都是空气的组成成分。其中氧气按体积计约占1/5,它跟人类生活、生产关系密切,是人类维持生命不可缺少的物质。 【揭示课题】氧气的性质和用途(板书) 你每时每刻都要接触氧气、使用氧气,你能描述它的哪些性质? 一、氧气的物理性质(板书)。 色______,状态_______,气味______。 【阅读】阅读课本,了解氧气的密度、熔点、沸点和在水中的溶解性等物理性质。 指出气体的密度跟温度、压强有关,气体的熔点、沸点及其在水中的溶解性跟压强有关。 二、氧气的化学性质(板书) 【演示实验】 1.木炭在氧气中燃烧,2.硫在氧气中燃烧,3.磷在氧气中燃烧,4.铁丝在氧气中燃烧。 观察要点: ①反应物的状态和色泽;②物质在空气中和在氧气中燃烧的不同点,③反应条件及现象描述,④在反应中的能量变化,⑤生成物的状态及检验。 (要求学生仔细观察,逐项填入下表。) 【投影】 物质和氧气反应记录表
(实验中教师边演示边逐项引导,并突出下列要点。) ①反应物需要点燃。 ②能量变化表现在产生光和热。 ③硫、磷燃烧有火焰,而碳、铁灼热发白光。 ④硫燃烧时生成有刺激性气味的气体,磷燃烧时有白烟生成,铁燃烧时生成球状固体(有液滴形成)。 ⑤生成物都是一种物质。 【小结】非金属和金属差不多都能跟氧气剧烈反应,产生光和热。 【讨论】上述物质和氧气反应的共同点是什么? 【小结】1.它们都有两种物质参加反应,其中一种是氧气。 2.它们都只生成一种物质。 【阅读】课本 【板书】化合反应:两种或两种以上物质生成另一种物质的反应。 判断是不是化合反应,要看生成物是否只有一种物质。 简述其他共同点:点燃、产生光和热。 【讨论】上述物质跟氧气反应有哪些不同点? 【小结】硫、磷燃烧有火焰,而木炭、铁丝燃烧无火焰。反应中燃烧有无火焰,看燃烧物是否是气体或蒸气。硫、磷的沸点低,它们先气化成蒸气再燃烧,因此有火焰。而碳、铁沸点高,在这一温度下并不气化,所以只看到灼热的白光。 【讨论】课本习题 【实验作业】在你的桌上有三支试管,分别装有氮气、空气和氧气,请你检验出哪一瓶内装氧气。 【小结】可用带火星的木条检验氧气。 【思考】能否用一个实验把氧气、空气同时检验出来? 【引言】前面都是单质和氧气的反应,很多化合物也能在氧气中燃烧。 【演示】5.蜡烛(含碳、氢成分的石蜡)在氧气中燃烧(请你仔细观察,把现象记录好。)
【讨论】这反应是不是化合反应,为什么? (不是,生成物有两种。) 这个反应和前面物质和氧气反应的共同之处是什么? (它们都是物质跟氧气反应,都要有点燃的反应条件,燃烧时都伴随光和热。) 【小结】物质和氧的反应叫氧化反应。(板书) 判断是不是氧化反应,只要看有没有氧(不一定是氧气)参加。前面一些反应既是化合反应,又是氧化反应。 【讨论】通过上面的实验,你对氧气的性质有怎样的认识? (氧气是化学性质比较活泼的气体,在氧化反应中提供氧,具有氧化性。) 【讲解】通过对氧气性质的了解,我们就可以进一步了解氧气的用途。 【板书】三、氧气的用途 【阅读课文】(略) 【讨论、小结】l.供给呼吸、维持生命和支持燃烧。 2.氧气易跟其他物质反应,放出热量,因此用于炼钢、焊接、切割金属,也可作火箭燃料的氧化剂等。 【作业】(略) 教学说明 (略) 专家讲评 用展示的未知气体作为问题情景,通过演示、检验引入教学课题,颇有新意。 在做演示实验时,作者强调实验的观察要点,这为讲解教学内容奠定基础,也对落实“双基”、培养能力作好必要的准备。 本教案写得很实在,启发、引导、讨论和小结运用得当,在变更教学方式中能明显感受师生在课堂教学中积极交流的活跃气氛。 |